تلاش برای ساخت باتری یون کلسیم بهجای یون لیتیوم: چرا و چگونه؟
از زمان کشف برق بهاین سو، مخترعان پیوسته برای بهبود شیوههای ذخیره آن کوشیدهاند. باتریها چون رایجترین ابزار شیمیایی ذخیره برق بوده و هستند، روند تکامل نسبتا سریعی داشتند، اما تلاش برای افزایش بازده آنها و کاهش هزینهها و پیامدهای زیستمحیطیشان همچنان ادامه دارد. امروزه باتریهای یونلیتیوم جزء تقریبا لاینفک دستگاههای دیجیتال و خودروهای برقی هستند.
باتری یون لیتیوم را بهاین نام میخوانند زیرا حرکت یونهای لیتیوم درون آن، جریان برق ایجاد میکند. اما استخراج لیتیوم پرهزینه، مدیریت و فرآوریش خطرناک و بازیابی آن دشوار است. ضمنا تقاضا برای لیتیوم دارد بر ظرفیت تولید آن پیشی میگیرد، زیرا لیتیوم فلز چندان فراوانی نیست و معادن لیتیوم از نظر جغرافیایی پراکندگی کمی دارند.
همین موضوع، زنجیره تامین لیتیوم را نیز با مشکل مواجه میکند. برای مثال بررسیها نشان میدهند که نیاز اروپا به لیتیوم تا سال 2050 میلادی بیش از 60 برابر خواهد شد. بههمین علت، دانشمندان عناصر و ترکیبات مختلفی را میآزمایند تا شاید لیتیوم را با ماده مناسبتری جایگزین کنند. دکتر پالاسین و کارشناسان تحت سرپرستی او در موسسه علوم مواد بارسلونا از آن جملهاند.
آنها در پی ساخت نوعی باتری هستند که بهجای لیتیوم از کلسیم بهره میبرد. حجم کلسیم موجود در پوسته زمین در مقایسه با لیتیوم حدوداً 2000 برابر است. ضمنا کلسیم برخلاف لیتیوم در مناطق جغرافیایی معدودی متمرکز نیست و همهجا یافت میشود. طبیعتاً وقتی ماده اولیه ارزان باشد، هزینه باتری نیز کاهش مییابد.
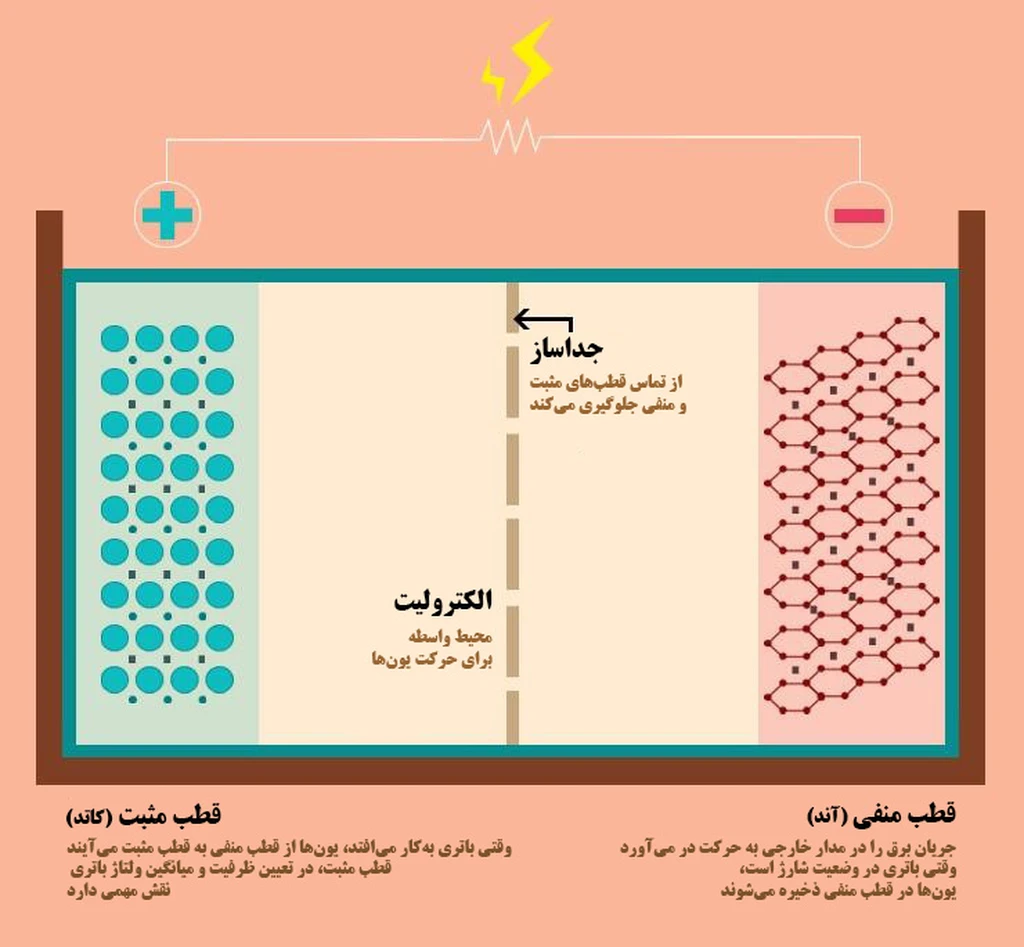
نگاهی به ساختار کلی باتریهای شیمیایی
همه باتریهای شیمیایی ساختار کلی مشابهی دارند که میتوان آنرا در چهار بخش اصلی خلاصه کرد:
- قطب یا الکترود مثبت (کاتد)
- قطب یا الکترود منفی (آند)
- محلول رسانا (الکترولیت)
- دیواره جداساز (separator)
الکترولیت محلولی است که یونهای مثبت درون آن بین دو قطب باتری جابهجا میشوند. وقتی باتری کار میکند، یونهای مثبت درون الکترولیت از قطب منفی به قطب مثبت جاری میشوند و وقتی باتری در وضعیت شارژ است، جهت جریان یونها معکوس میشود. دیواره جداساز نیز مانع میشود تا قطب مثبت و منفی مستقیما در تماس باشند.
در قطب مثبت باتریهای لیتیومی معمولا از اکسید لیتیوم و گاهی از دیگر ترکیبات لیتیومی استفاده میشود. وقتی باتری در وضعیت شارژ است، یونهای لیتیوم در قطب مثبت جمع میشوند و وقتی باتری کار میکند، یونهای مثبت مجددا به درون الکترولیت باز میگردند. نمک لیتیوم رایجترین ماده در ساخت محلول الکترولیت است.
باتری یون کلسیم بهجای یون لیتیوم
در قطب منفی باتریهای لیتیومی معمولا گرافیت استفاده میشود که رسانای خوب و ارزانی است. اما استفاده از کلسیم در قطب منفی باتری بهجای گرافیت، چگالی انرژی یا مقدار انرژی قابل ذخیرهسازی باتری را افزایش میدهد. بهعبارت دیگر، با بهکارگیری فلزی مثل کلسیم در یکی از قطبهای باتری، چگالی انرژی افزایش چشمگیری مییابد.
چگالی انرژی باتریهای یون لیتیوم کمتر است، زیرا لیتیوم فلز بسیار واکنشپذیری است و نمیتوان آنرا در قطب باتری بهکار برد. قطب لیتیومی تدریجاً دندانهها یا اصطلاحا دندریتهایی تشکیل میدهد که بهمرور درون باتری لیتیومی پخش میشوند و سپس درون باتری مدار کوتاه ایجاد میکنند یا حتی در درازمدت ممکن است باتری را منفجر کنند.
عنصر کلسیم از نظر ساختاری نیز مزیتی دارد که محققان میتوانند از آن بهره ببرند: کلسیم در لایه ظرفیت یا اصطلاحا لایه والانس خود میتواند دو الکترون از دست دهد (و به یون مثبت Ca2+ تبدیل شود)، اما اتمهای لیتیوم فقط یک الکترونِ ظرفیت دارند. همین ویژگی میتواند ظرفیت انرژی باتری کلسیمی را افزایش دهد؛ بهشرطی که برای قطب مثبت باتری نیز ماده مناسبی پیدا شود.
یافتن نمک مناسب
یونهای Ca2+ و مولکولهای ماده حلّال درون الکترولیت، برهمکنشهای متعددی دارند که مانع حرکت یونهای کلسیم میشود. پالاسین میگوید رسانای خوب، رسانایی است که یونها درونش سریعتر حرکت کنند تا نهایتا توان باتری افزایش یابد.
محققان برای حل این مشکل نمکها و حلّالهای مختلفی را آزمودند تا الکترولیتی بیابند که بتواند در قطب کلسیمی، لایه غیرفعالساز (passivation layer) ایجاد کند و نتیجتاً (واکنشهای ناخواسته کاهش یابد و) حرکت یونها تسهیل شود.
سرانجام پس از بررسیها مشخص شد که ظاهرا همه نمکهایی که برای این منظور الکترولیت مناسبی هستند، آنهایی هستند که از عنصر «بور» بهره میبرند. محققان از تترافلئوروبورات کلسیم محلول در کربنات اتیلن و پروپیلن بهره بردند. در گام بعدی جهت تجاریسازی باتری، باید روشهای بهکار رفته برای تولید قطب منفی مبتنی بر کلسیم بهبود یابد و نیز برای این نوع باتری، قطب مثبت مناسبی ساخته شود.